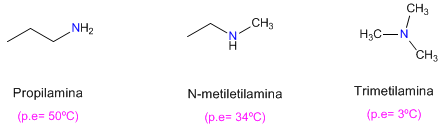
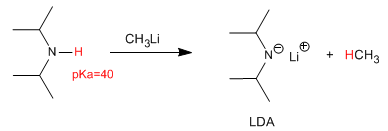
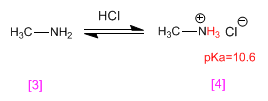
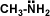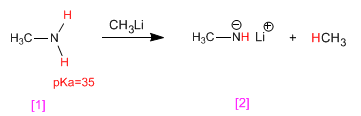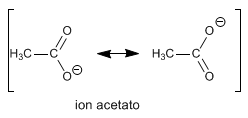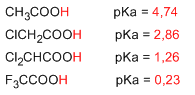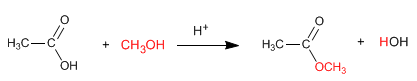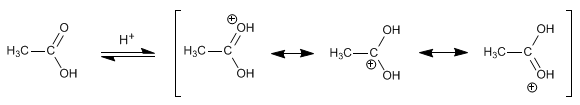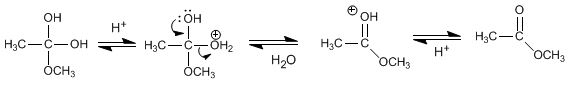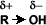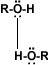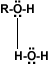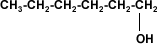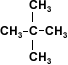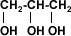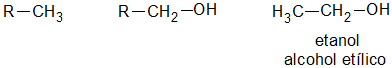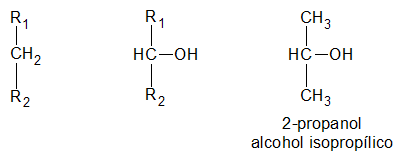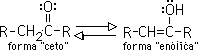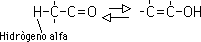ALCOHOLES Y FENOLES
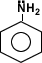
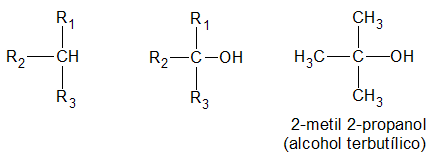
los alcoholes son compuestos con grupos hidroxilo unidos a átomos de carbono no saturados con hibridación sp3 en tanto que los fenoles son compuestos que tienen grupos hidroxilo unidos a anillos aromáticos .
ambos se pueden considerar como compuestos derivados del agua en un grupo orgánico ha sustituido a unos de los hidrógenos H-O-H en comparación con R-O-H o Ar-O-H.
los alcoholes se encuentran ampliamente distribuidos en la naturaleza, tiene muchas aplicaciones industriales y farmacéuticas.
los fenoles son también muy abundantes en la naturaleza y también sirven como intermediarios en la síntesis industria de productos tan diversos como adhesivos y antisépticos.
el fenol es un desinfectante general que se encuentra en el alquitrán de hulla, el silicato de metilo es un agente saborizante que se halla en el aceite esencial de sauce, los uroshioles son los constituyentes alergenicos del roble venenoso y de la hiedra venenosa.
los aldehídos, cetonas, ácidos carboxílicos ,los esteres se reducen por la acción de NaBH4 o LiAlH4.
los aldehídos,esteres y ácidos carboxílicos producen por reducción alcoholes primarios (RCH2OH).
los fenoles son las contrapartes aromáticas de los alcoholes pero son mas ácidos con un pK cercano a 10, porque sus aniones ,los aniones fenoxido, están estabilizados por la deslocalización de la carga negativa hacia el anillo aromático.
los fenoles se pueden oxidar a las quinosas al reaccionar con la sal de Fremy (nitrosodisulfato de potasio), y las quinoas pasan a hidroquinasas.
ESTERES Y EPOXIDOS, TIOLES Y SULFUROS.
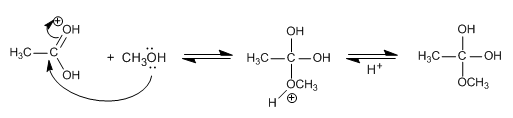
Un éter es una sustancia que tiene dos grupos orgánicos unidos al mismo atoo de carbono R´-O-R. Los grupos orgánicos pueden ser alquilos, arilos o vinilicos y el átomo de oxigeno puede estar en una cadena abierta o ser parte de un anillo.
probablemente el éter mas conocido sea el di etílico, usado como anestésico y en la industria como disolvente.
Los éteres son relativamente estables y no reactivos en muchos aspectos pero algunos reaccionan lentamente con el aire y forman peroxidos,compuestos que tienen el enlace O-O.
los éteres son muy útiles como disolventes en el laboratorio, pero se deben utilizar con cuidado.
Tioles y Sulfuros: los tioles RSH en ocasiones mercaptanos son los análogos con azufre de los alcoholes y los sulfuros RSR son análogos con azufre de los éteres.
La nomenclatura de los tioles conserva el sistema utilizado para los alcoholes con el sufijo TIOL en vez del OL el grupo -SH se conoce como un grupo mercapto.
Los epóxidos son éteres cíclicos con un anillo de tres miembros que contiene oxigeno debido a la tensión en el anillo.
Los epóxidos se pueden abrir con ácidos y bases.
La apertura del anillo con ácidos ocurre con una region quimica que depende de la estructura del epóxido.
Por lo general los TIOLES, análogos con azufre de los alcoholes se preparan por la reacción de Sn2 de un halogenuro de alquilo con tiourea .
la oxidación suave de un tiol produce un disulfuro y una reacción suave de un disulfuro da un tio.
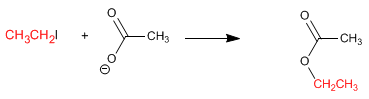
Los sulfuros análogos con azufre de los éteres, se preparan por una reacción Sn2 tipo Williamson entre un ion tiolato y un halogenuro primario o secundario.
INTRODUCCION A LOS COMPUESTOS CARBONILICOS
En la naturaleza los compuestos carbonilicos están casi todas las moléculas con importancia bilogica al igual que en muchos agentes farmacéuticos y sustancias químicas sintéticas con las que nos relacionamos todos los días, contienen grupos carbonilo.
El acido acético es un componente principal del vinagre, el acetaminofen, es el ingrediente activo en muchos de los medicamentos para combatir el dolor de cabeza, y el dacron el material de poliéster utilizado en prendas de vestir. Todos contienen diferentes tipos de grupos carbonilo
ALDEHIDOS Y CETONAS:REACCIONES NUCLEOFILAS DE ADICION.
Los aldehídos y cetonas son los que más se encuentran tanto en la industria como en la naturaleza, una buena parte de las sustancias necesarias para los organismos vivos son los aldehídos y cetonas.
En la industria química se producen aldehídos y cetonas simples en grandes cantidades para utilizarlas como disolventes y como materias primas, con el fin de preparar muchos otros compuestos, por ejemplo: se fabrica formaldehido para la preparación de aislantes y en las resinas adhesivas que se utilizan en las tablas de conglomerado y triplay.
la acetona es tan importante que en Estados Unidos se producen 1.2 millones de toneladas al año para utilizarse como disolventes .
El formaldehido se sintetiza en la industria por medio de la oxidación catalítica del metanol; por otra parte ,un método de preparación de acetona implica la oxidación del 2-propanol.
L reacción de adición nucleofila es la mas común de los aldehídos y las cetonas. Es posible preparar muchos de los productos mediante adiciones nucleofilas.
Los aldehídos y cetonas se reducen con NaBH4 o LiAlH4 para producir alcoholes primarios o secundarios, respectivamente con la adición de reactivos de Grignar a los aldehídos y cetonas, también dan lugar a alcoholes (secundarios y terciarios respectivamente) y la adición de HCN produce cianohidrinas. Las aminas primarias se adicionan a los compuestos carbonilicos para formar iminas y las aminas secundarias forman enaminas.
la reacción de un aldehído o una cetona con hidrazina y bases produce un alcano .
Los alcoholes se adicionan a los grupos carbonilo para generar acetales que son valiosos como grupos protectores. Los fosfóranos se adicionan a los aldehídos y cetonas para producir alquenos en las que el nuevo enlace es C=C en el producto se encuentra exactamente donde estaba el enlace C=O en la materia prima.
Con frecuencia los aldehídos y las cetonas alfa-beta saturadas reaccionan con nucleófilos, el producto es la adición conjugada o adición 1,4. Es muy utilla reacción con un reactivo diorganocobre en la cual se lleva a cavo la reacción del grupo alquilo, arilo o alquenilo.
la electroscopia de infrarrojo es muy útil para identificar aldehídos y cetonas
los grupos carbonilo absorben en el intervalo de 1660 a 1770cm -1 y la posición exacta de la banda de absorción permite identificar e tipo de grupo carbonilo presente a la molécula.
los alcoholes son compuestos con grupos hidroxilo unidos a átomos de carbono no saturados con hibridación sp3 en tanto que los fenoles son compuestos que tienen grupos hidroxilo unidos a anillos aromáticos .
ambos se pueden considerar como compuestos derivados del agua en un grupo orgánico ha sustituido a unos de los hidrógenos H-O-H en comparación con R-O-H o Ar-O-H.
los alcoholes se encuentran ampliamente distribuidos en la naturaleza, tiene muchas aplicaciones industriales y farmacéuticas.
los fenoles son también muy abundantes en la naturaleza y también sirven como intermediarios en la síntesis industria de productos tan diversos como adhesivos y antisépticos.
el fenol es un desinfectante general que se encuentra en el alquitrán de hulla, el silicato de metilo es un agente saborizante que se halla en el aceite esencial de sauce, los uroshioles son los constituyentes alergenicos del roble venenoso y de la hiedra venenosa.
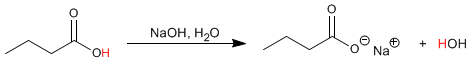
los aldehídos, cetonas, ácidos carboxílicos ,los esteres se reducen por la acción de NaBH4 o LiAlH4.
los aldehídos,esteres y ácidos carboxílicos producen por reducción alcoholes primarios (RCH2OH).
los fenoles son las contrapartes aromáticas de los alcoholes pero son mas ácidos con un pK cercano a 10, porque sus aniones ,los aniones fenoxido, están estabilizados por la deslocalización de la carga negativa hacia el anillo aromático.
los fenoles se pueden oxidar a las quinosas al reaccionar con la sal de Fremy (nitrosodisulfato de potasio), y las quinoas pasan a hidroquinasas.
ESTERES Y EPOXIDOS, TIOLES Y SULFUROS.
Un éter es una sustancia que tiene dos grupos orgánicos unidos al mismo atoo de carbono R´-O-R. Los grupos orgánicos pueden ser alquilos, arilos o vinilicos y el átomo de oxigeno puede estar en una cadena abierta o ser parte de un anillo.
probablemente el éter mas conocido sea el di etílico, usado como anestésico y en la industria como disolvente.
Los éteres son relativamente estables y no reactivos en muchos aspectos pero algunos reaccionan lentamente con el aire y forman peroxidos,compuestos que tienen el enlace O-O.
los éteres son muy útiles como disolventes en el laboratorio, pero se deben utilizar con cuidado.
Tioles y Sulfuros: los tioles RSH en ocasiones mercaptanos son los análogos con azufre de los alcoholes y los sulfuros RSR son análogos con azufre de los éteres.
La nomenclatura de los tioles conserva el sistema utilizado para los alcoholes con el sufijo TIOL en vez del OL el grupo -SH se conoce como un grupo mercapto.
Los epóxidos son éteres cíclicos con un anillo de tres miembros que contiene oxigeno debido a la tensión en el anillo.
Los epóxidos se pueden abrir con ácidos y bases.
La apertura del anillo con ácidos ocurre con una region quimica que depende de la estructura del epóxido.
Por lo general los TIOLES, análogos con azufre de los alcoholes se preparan por la reacción de Sn2 de un halogenuro de alquilo con tiourea .
la oxidación suave de un tiol produce un disulfuro y una reacción suave de un disulfuro da un tio.
Los sulfuros análogos con azufre de los éteres, se preparan por una reacción Sn2 tipo Williamson entre un ion tiolato y un halogenuro primario o secundario.
INTRODUCCION A LOS COMPUESTOS CARBONILICOS
En la naturaleza los compuestos carbonilicos están casi todas las moléculas con importancia bilogica al igual que en muchos agentes farmacéuticos y sustancias químicas sintéticas con las que nos relacionamos todos los días, contienen grupos carbonilo.
El acido acético es un componente principal del vinagre, el acetaminofen, es el ingrediente activo en muchos de los medicamentos para combatir el dolor de cabeza, y el dacron el material de poliéster utilizado en prendas de vestir. Todos contienen diferentes tipos de grupos carbonilo
ALDEHIDOS Y CETONAS:REACCIONES NUCLEOFILAS DE ADICION.
Los aldehídos y cetonas son los que más se encuentran tanto en la industria como en la naturaleza, una buena parte de las sustancias necesarias para los organismos vivos son los aldehídos y cetonas.
En la industria química se producen aldehídos y cetonas simples en grandes cantidades para utilizarlas como disolventes y como materias primas, con el fin de preparar muchos otros compuestos, por ejemplo: se fabrica formaldehido para la preparación de aislantes y en las resinas adhesivas que se utilizan en las tablas de conglomerado y triplay.
la acetona es tan importante que en Estados Unidos se producen 1.2 millones de toneladas al año para utilizarse como disolventes .
El formaldehido se sintetiza en la industria por medio de la oxidación catalítica del metanol; por otra parte ,un método de preparación de acetona implica la oxidación del 2-propanol.
L reacción de adición nucleofila es la mas común de los aldehídos y las cetonas. Es posible preparar muchos de los productos mediante adiciones nucleofilas.
Los aldehídos y cetonas se reducen con NaBH4 o LiAlH4 para producir alcoholes primarios o secundarios, respectivamente con la adición de reactivos de Grignar a los aldehídos y cetonas, también dan lugar a alcoholes (secundarios y terciarios respectivamente) y la adición de HCN produce cianohidrinas. Las aminas primarias se adicionan a los compuestos carbonilicos para formar iminas y las aminas secundarias forman enaminas.
la reacción de un aldehído o una cetona con hidrazina y bases produce un alcano .
Los alcoholes se adicionan a los grupos carbonilo para generar acetales que son valiosos como grupos protectores. Los fosfóranos se adicionan a los aldehídos y cetonas para producir alquenos en las que el nuevo enlace es C=C en el producto se encuentra exactamente donde estaba el enlace C=O en la materia prima.
Con frecuencia los aldehídos y las cetonas alfa-beta saturadas reaccionan con nucleófilos, el producto es la adición conjugada o adición 1,4. Es muy utilla reacción con un reactivo diorganocobre en la cual se lleva a cavo la reacción del grupo alquilo, arilo o alquenilo.
la electroscopia de infrarrojo es muy útil para identificar aldehídos y cetonas
los grupos carbonilo absorben en el intervalo de 1660 a 1770cm -1 y la posición exacta de la banda de absorción permite identificar e tipo de grupo carbonilo presente a la molécula.