AlcoholesAlcoholes son aquellos compuestos orgánicos en cuya estructura se encuentra el grupo hidroxilo (-OH), unido a un carbono que solo se acopla a otro carbono o a hidrógenos.
Pueden ser alifáticos (R-OH) o aromáticos (Ar-OH) estos últimos se conocen como fenoles.
Son un grupos de compuestos muy importantes, no solo por su utilidad industrial, de laboratorio, teórica, o comercial, si no también, porque se encuentran muy extensamente en la vida natural.
Cuando en la molécula del alcohol hay mas de un grupo hidroxilo se les llama polioles o alcoholes polihídricos. Si son dos grupos hidroxilos se llaman glicoles, tres, gliceroles, cuatro tetrioles y así sucesivamente.
NomenclaturaEs común que los alcoholes se nombren usando la palabra alcohol como nombre, y con el "apellido" del grupo correspondiente a los alcanos básicos que le dan lugar, esta nomenclatura se ilustra a continuación.

PROPIEDADES FISICAS
Propiedades Físicas:
El grupo –OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas neutras.
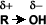
Solubilidad: Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2-propanol.
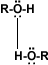
alcohol-alcohol
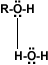
alcohol-agua
A partir de 4 carbonos en la cadena de un alcohol, su solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en comparación con la porción hidrocarburo. A partir del hexanol son solubles solamente en solventes orgánicos.
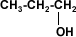
1 propanol
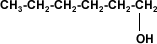
Hexanol
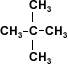
2-metil-2-propanol
Existen alcoholes de cuatro átomos de carbono que son solubles en agua, debido a la disposición espacial de la molécula. Se trata de moléculas simétricas
Existen alcoholes con múltiples moléculas de OH (polihidroxilados) que poseen mayor superficie para formar puentes de hidrógeno, lo que permiten que sean bastante solubles en agua.
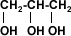
1,2,3 propanotriol (glicerina)
CLASIFICACIONLos alcoholes son el grupo de compuestos químicos que resultan de la sustitución de uno o varios átomos de hidrógeno (H) por grupos hidroxilo (-OH) en los hidrocarburos saturados o no saturados.
Alcoholes primarios, secundarios y terciarios
Un alcohol es primario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) primario:
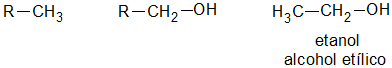
es secundario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) secundario:
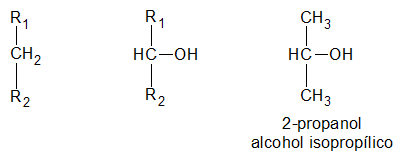
y finalmente, es terciario, si el átomo de hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) terciario:
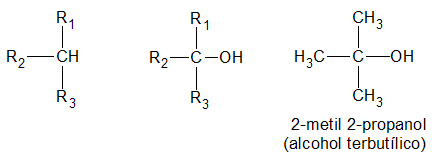
La función alcohol puede repetirse en la misma molécula, resultando monoles, o alcoholes monovalentes; dioles, o alcoholes bivalentes; trioles, o alcoholes trivalentes, etc.
ETANOL
El compuesto químico etanol, conocido como alcohol etílico, es un alcohol que se presenta en condiciones normales de presión y temperatura como un líquido incoloro e inflamable con un punto de ebullición de 78 °C.
Mezclable con agua en cualquier proporción; a la concentración de 95% en peso se forma una mezcla azeotrópica.
Su fórmula química es CH3-CH2-OH (C2H6O), principal producto de las bebidas alcohólicas como el vino (alrededor de un 13%), la cerveza (5%) o licores (hasta un 50%).
Además de usarse con fines culinarios (bebida alcohólica), el etanol se utiliza ampliamente en muchos sectores industriales y en el sector farmacéutico, como excipiente de algunos medicamentos y cosméticos (es el caso del alcohol antiséptico 70º GL y en la elaboración de ambientadores y perfumes).
Es un buen disolvente, y puede utilizarse como anticongelante. También es un desinfectante. Su mayor potencial bactericida se obtiene a una concentración de aproximadamente el 70%.
Industria química
La industria química lo utiliza como compuesto de partida en la síntesis de diversos productos, como el acetato de etilo (un disolvente para pegamentos, pinturas, etc.), el éter dietílico, etc.
También se aprovechan sus propiedades desinfectantes.
CombustibleEtanol (combustible)
Se emplea como combustible industrial y doméstico. En el uso doméstico se emplea el alcohol de quemar. Este además contiene compuestos como la pirovidos exclusivamente a alcohol. Esta última aplicación se extiende también cada vez más en otros países para cumplir con el protocolo de Kyoto. Estudios del Departamento de Energía de EUA dicen que el uso en automóviles reduce la producción de gases de invernadero en un 85%. En países como México existe la política del ejecutivo federal de apoyar los proyectos para la producción integral de etanol y reducir la importación de gasolinas que ya alcanza el 60%.
METANOL
Mezclable con agua en cualquier proporción; a la concentración de 95% en peso se forma una mezcla azeotrópica.
Su fórmula química es CH3-CH2-OH (C2H6O), principal producto de las bebidas alcohólicas como el vino (alrededor de un 13%), la cerveza (5%) o licores (hasta un 50%).
Además de usarse con fines culinarios (bebida alcohólica), el etanol se utiliza ampliamente en muchos sectores industriales y en el sector farmacéutico, como excipiente de algunos medicamentos y cosméticos (es el caso del alcohol antiséptico 70º GL y en la elaboración de ambientadores y perfumes).
Es un buen disolvente, y puede utilizarse como anticongelante. También es un desinfectante. Su mayor potencial bactericida se obtiene a una concentración de aproximadamente el 70%.
Industria química
La industria química lo utiliza como compuesto de partida en la síntesis de diversos productos, como el acetato de etilo (un disolvente para pegamentos, pinturas, etc.), el éter dietílico, etc.
También se aprovechan sus propiedades desinfectantes.
CombustibleEtanol (combustible)
Se emplea como combustible industrial y doméstico. En el uso doméstico se emplea el alcohol de quemar. Este además contiene compuestos como la pirovidos exclusivamente a alcohol. Esta última aplicación se extiende también cada vez más en otros países para cumplir con el protocolo de Kyoto. Estudios del Departamento de Energía de EUA dicen que el uso en automóviles reduce la producción de gases de invernadero en un 85%. En países como México existe la política del ejecutivo federal de apoyar los proyectos para la producción integral de etanol y reducir la importación de gasolinas que ya alcanza el 60%.
METANOL
El compuesto químico metanol, también conocido como alcohol metílico o alcohol de madera, es el alcohol más sencillo. A temperatura ambiente se presenta como un líquido ligero (de baja densidad), incoloro, inflamable y tóxico que se emplea como anticongelante, disolvente y combustible. Su fórmula química es CH3OH (CH4O).
El metanol tiene varios usos. Es un disolvente industrial y se emplea como materia prima en la fabricación de formaldehído. El metanol también se emplea como anticongelante en vehículos, combustible de bombonas de camping-gas, disolvente de tintas, tintes, resinas, adhesivos ,biocombustibles y aspartamo. El metanol puede ser también añadido al etanol para hacer que éste no sea apto para el consumo humano (el metanol es altamente tóxico) y para vehículos de modelismo con motores de explosión.
REACCIONES FUNDAMENTALES
Oxidación de alcoholes
Alcohol primario: se utiliza la piridina (Py) para detener la reacción en el aldehído Cr03 / H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico.
Alcohol secundario: se obtiene una cetona y agua.
Alcohol terciario: si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza uno enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano.
Deshidratación de alcoholes
La deshidratación de alcoholes es el proceso químico que consiste en la transformación de un alcohol para poder ser un alqueno por procesos de eliminación. Para realizar este procedimiento se utiliza un ácido mineral para extraer el grupo hidroxilo (OH) desde el alcohol, generando una carga positiva en el carbono del cual fue extraído el Hidroxilo el cual tiene una interacción eléctrica con los electrones más cercanos (por defecto, electrones de un hidrógeno en el caso de no tener otro sustituyente) que forman un doble enlace en su lugar.
Por esto, la deshidratación de alcoholes es útil, puesto que fácilmente convierte a un alcohol en un alqueno.
Un ejemplo simple es la síntesis del ciclohexeno por deshidratación del ciclohexanol. Se puede ver la acción del ácido (H2SO4) ácido sulfúrico el cual quita el grupo hidroxilo del alcohol, generando el doble enlace y agua.
Éteres a partir de Alcoholes
Condensación entre alcoholes primarios
Cuando un alcohol primario se trata con sulfúrico concentrado y calentando a 130ºC, se produce la protonación de algunas moléculas que son atacadas por otras moléculas de alcohol sin protonar generándose un éter. La temperatura elevada es necesaria ya que los alcoholes son malos nucleófilos y el mecanismo que sigue esta reacción es SN2.

En esta reacción debe utilizarse un sólo tipo de alcohol que da un éter simétrico, dos alcoholes diferentes producirían una mezcla de éteres.
Uno de los alcoholes es secundario o terciario
Cuando uno de los alcoholes es secundario o terciario forma fácilmente el carbocatión por perdida de agua, que es atrapado por el otro alcohol formando el éter.

Acidez de los alcoholes
La gran electronegatividad del oxígeno provoca que el hidrógeno pueda ser arrancado por bases. La acidez de los alcoholes viene dada por la constante del siguiente equilibrio, cuyo logaritmo cambiado de signo nos da el pKa.
CH3OH + H2O ↔ CH3O- + H3O+
Ka = [CH3O-][H3O+]/[CH3OH]
pKa = -logKa
Valores de pKa para alcoholes
Compuesto
pKa
H2O
15,7
CH3OH
15,5
CH3CH2OH
15,9
(CH3)2CHOH
17,1
(CH3)3COH
18
ClCH2CH2OH
14.3
CF3CH2OH
12,4
En la tabla se pueden observar dos tendencias:
El pKa aumenta al aumentar el tamaño de la cadena carbonada (H menos ácidos)
Los grupos electronegativos (halógenos) disminuyen el pKa (H más ácidos) ya que estabilizan la base conjugada.
Desplazamiento del equilibrio
Los hidrógenos ácidos tienen un valor de pKa pequeño y los poco ácidos valores de pKa elevados. El equilibrio entre el alcohol y el alcóxido se puede desplazar utilizando bases fuertes, como LDA, amiduro de sodio, hidruro de sodio.....
CH3OH + NH2- → CH3O-Na+ + NH3
pKa(CH3OH)=15.5
pKa(NH3)=35
El equilibrio se desplaza hacia el ácido de mayor pKa, cuanto mayor sea la diferencia entre los pKa más desplazado se encuentra.
CH3OH + Na+OH- ↔ CH3O-Na+ + H2O
pKa(CH3OH)=15.5
pKa(H2O)=15.7
Este equilibrio no se encuentra desplazado puesto que los valores de pKa del metanol y del agua son similares.
DIFERENCIA ENTRE FENOL Y ALCOHOL
1. El fenol es un grupo muy reactivo, es la base de innumerables sintesis organicas. Es un hidroxilo unido a un benceno.
2. El alcohol, es un hidroxilo unido a una cadena de carbonos, lineal. No es tan reactivo como el fenol, pero se usa mucho como solvente, en muchas industrias.
3. El peso molecular del fenol es mas alto, 94, el del alcohol es mas bajo, 46.07.
4. El punto de fusion del fenol es bajo = 43 grados centigrados, el del alcohol es mas alto= menos 114.25 grados centigrados.
5. el punto de ebullicion del fenol es alto= 182 grados centigrados, el del alcohol = 78 grados centigrados.
6. La sintesis del fenol es mas compleja que la obtencion de alcohol por fermentacion del azucar.
7. Ambos son toxicos, pero el fenol es mas toxico que el etanol.
POLIOLES
Los polioles son alcoholes polihídricos con varios grupos hidroxilo. La fórmula química general es CnH2n+2On. Un poliol es un carbohidrato que contiene más grupos hidroxilo que el azúcar al cual está asociado. Por ejemplo, si un grupo hidroxilo remplaza al grupo cetona de una cetosa o al grupo aldehído de una aldosa se obtiene un alcohol de azúcar. Así de la manosa se obtiene manitol, de la glucosa se obtiene glucitol (conocido como sorbitol), de la galactosa se obtiene galactitol (conocido como dulcitol), etc
Son edulcorantes con bajo contenido energético (debido a su absorción parcial en el intestino) que, en muchos casos, se prefieren antes que a los azúcares edulcorantes debido a que no afectan los niveles de azúcar en sangre y no provoca la aparición de caries dentales.
ClasificaciónLos polioles pueden clasificarse en alditoles y inositoles o ciclitoles.
Los alditoles tienen una cadena linear de átomos de carbono. También se les conoce como polioles alifáticos. Los inositoles o ciclitoles tienen una cadena cíclica de átomos de carbono.
Los enoles son compuestos en lo que uno de los átomos de hidrógeno unido a un carbono de un doble enlace es remplazado por un grupo hidroxilo. Los enoles están relacionados con los compuestos carbonílicos por un equilibrio de transferencia protónica conocida como tautomería ceto-enólica
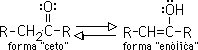
Esta tautomería ceto-enólica es característica de todos los compuestos carbonílicos que contengan hidrógenos alfa (hidrógenos en un carbono adyacente al carbonilo). La forma ceto y la forma enólica no son sino isómeros en equilibrio; el sistema se genera por la migración reversible del hidrógeno alfa al oxígeno del grupo carbonilo:
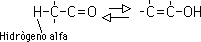
Sólo una pequeña cantidad del enol está presente en un aldehído o una cetona simple, por lo que la forma "ceto" prevalece sobre la forma "enólica". Sin embargo, hay casos en que el equilibrio favorece a la forma enólica. Por ejemplo, en 2,4 pentadiona el isómero enólico compara en estabilidad con la forma ceto y podría predominar en el equilibrio:
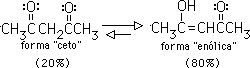
Cuando se remueve el protón del enol o del compuesto carbonílico en equilibrio con éste,se produce un anión deslocalizado conocido como ion enolato:

La formación del enolato de 2,4-pentadiona se favorece porque la carga negativa puede deslocalizarse entre los dos carbonilos
El metanol tiene varios usos. Es un disolvente industrial y se emplea como materia prima en la fabricación de formaldehído. El metanol también se emplea como anticongelante en vehículos, combustible de bombonas de camping-gas, disolvente de tintas, tintes, resinas, adhesivos ,biocombustibles y aspartamo. El metanol puede ser también añadido al etanol para hacer que éste no sea apto para el consumo humano (el metanol es altamente tóxico) y para vehículos de modelismo con motores de explosión.
REACCIONES FUNDAMENTALES
Oxidación de alcoholes
Alcohol primario: se utiliza la piridina (Py) para detener la reacción en el aldehído Cr03 / H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico.
Alcohol secundario: se obtiene una cetona y agua.
Alcohol terciario: si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza uno enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano.
Deshidratación de alcoholes
La deshidratación de alcoholes es el proceso químico que consiste en la transformación de un alcohol para poder ser un alqueno por procesos de eliminación. Para realizar este procedimiento se utiliza un ácido mineral para extraer el grupo hidroxilo (OH) desde el alcohol, generando una carga positiva en el carbono del cual fue extraído el Hidroxilo el cual tiene una interacción eléctrica con los electrones más cercanos (por defecto, electrones de un hidrógeno en el caso de no tener otro sustituyente) que forman un doble enlace en su lugar.
Por esto, la deshidratación de alcoholes es útil, puesto que fácilmente convierte a un alcohol en un alqueno.
Un ejemplo simple es la síntesis del ciclohexeno por deshidratación del ciclohexanol. Se puede ver la acción del ácido (H2SO4) ácido sulfúrico el cual quita el grupo hidroxilo del alcohol, generando el doble enlace y agua.
Éteres a partir de Alcoholes
Condensación entre alcoholes primarios
Cuando un alcohol primario se trata con sulfúrico concentrado y calentando a 130ºC, se produce la protonación de algunas moléculas que son atacadas por otras moléculas de alcohol sin protonar generándose un éter. La temperatura elevada es necesaria ya que los alcoholes son malos nucleófilos y el mecanismo que sigue esta reacción es SN2.

En esta reacción debe utilizarse un sólo tipo de alcohol que da un éter simétrico, dos alcoholes diferentes producirían una mezcla de éteres.
Uno de los alcoholes es secundario o terciario
Cuando uno de los alcoholes es secundario o terciario forma fácilmente el carbocatión por perdida de agua, que es atrapado por el otro alcohol formando el éter.

Acidez de los alcoholes
La gran electronegatividad del oxígeno provoca que el hidrógeno pueda ser arrancado por bases. La acidez de los alcoholes viene dada por la constante del siguiente equilibrio, cuyo logaritmo cambiado de signo nos da el pKa.
CH3OH + H2O ↔ CH3O- + H3O+
Ka = [CH3O-][H3O+]/[CH3OH]
pKa = -logKa
Valores de pKa para alcoholes
Compuesto
pKa
H2O
15,7
CH3OH
15,5
CH3CH2OH
15,9
(CH3)2CHOH
17,1
(CH3)3COH
18
ClCH2CH2OH
14.3
CF3CH2OH
12,4
En la tabla se pueden observar dos tendencias:
El pKa aumenta al aumentar el tamaño de la cadena carbonada (H menos ácidos)
Los grupos electronegativos (halógenos) disminuyen el pKa (H más ácidos) ya que estabilizan la base conjugada.
Desplazamiento del equilibrio
Los hidrógenos ácidos tienen un valor de pKa pequeño y los poco ácidos valores de pKa elevados. El equilibrio entre el alcohol y el alcóxido se puede desplazar utilizando bases fuertes, como LDA, amiduro de sodio, hidruro de sodio.....
CH3OH + NH2- → CH3O-Na+ + NH3
pKa(CH3OH)=15.5
pKa(NH3)=35
El equilibrio se desplaza hacia el ácido de mayor pKa, cuanto mayor sea la diferencia entre los pKa más desplazado se encuentra.
CH3OH + Na+OH- ↔ CH3O-Na+ + H2O
pKa(CH3OH)=15.5
pKa(H2O)=15.7
Este equilibrio no se encuentra desplazado puesto que los valores de pKa del metanol y del agua son similares.
DIFERENCIA ENTRE FENOL Y ALCOHOL
1. El fenol es un grupo muy reactivo, es la base de innumerables sintesis organicas. Es un hidroxilo unido a un benceno.
2. El alcohol, es un hidroxilo unido a una cadena de carbonos, lineal. No es tan reactivo como el fenol, pero se usa mucho como solvente, en muchas industrias.
3. El peso molecular del fenol es mas alto, 94, el del alcohol es mas bajo, 46.07.
4. El punto de fusion del fenol es bajo = 43 grados centigrados, el del alcohol es mas alto= menos 114.25 grados centigrados.
5. el punto de ebullicion del fenol es alto= 182 grados centigrados, el del alcohol = 78 grados centigrados.
6. La sintesis del fenol es mas compleja que la obtencion de alcohol por fermentacion del azucar.
7. Ambos son toxicos, pero el fenol es mas toxico que el etanol.
POLIOLES
Los polioles son alcoholes polihídricos con varios grupos hidroxilo. La fórmula química general es CnH2n+2On. Un poliol es un carbohidrato que contiene más grupos hidroxilo que el azúcar al cual está asociado. Por ejemplo, si un grupo hidroxilo remplaza al grupo cetona de una cetosa o al grupo aldehído de una aldosa se obtiene un alcohol de azúcar. Así de la manosa se obtiene manitol, de la glucosa se obtiene glucitol (conocido como sorbitol), de la galactosa se obtiene galactitol (conocido como dulcitol), etc
Son edulcorantes con bajo contenido energético (debido a su absorción parcial en el intestino) que, en muchos casos, se prefieren antes que a los azúcares edulcorantes debido a que no afectan los niveles de azúcar en sangre y no provoca la aparición de caries dentales.
ClasificaciónLos polioles pueden clasificarse en alditoles y inositoles o ciclitoles.
Los alditoles tienen una cadena linear de átomos de carbono. También se les conoce como polioles alifáticos. Los inositoles o ciclitoles tienen una cadena cíclica de átomos de carbono.
Los enoles son compuestos en lo que uno de los átomos de hidrógeno unido a un carbono de un doble enlace es remplazado por un grupo hidroxilo. Los enoles están relacionados con los compuestos carbonílicos por un equilibrio de transferencia protónica conocida como tautomería ceto-enólica
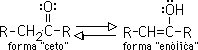
Esta tautomería ceto-enólica es característica de todos los compuestos carbonílicos que contengan hidrógenos alfa (hidrógenos en un carbono adyacente al carbonilo). La forma ceto y la forma enólica no son sino isómeros en equilibrio; el sistema se genera por la migración reversible del hidrógeno alfa al oxígeno del grupo carbonilo:
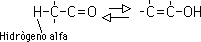
Sólo una pequeña cantidad del enol está presente en un aldehído o una cetona simple, por lo que la forma "ceto" prevalece sobre la forma "enólica". Sin embargo, hay casos en que el equilibrio favorece a la forma enólica. Por ejemplo, en 2,4 pentadiona el isómero enólico compara en estabilidad con la forma ceto y podría predominar en el equilibrio:
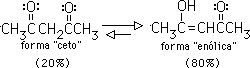
Cuando se remueve el protón del enol o del compuesto carbonílico en equilibrio con éste,se produce un anión deslocalizado conocido como ion enolato:

La formación del enolato de 2,4-pentadiona se favorece porque la carga negativa puede deslocalizarse entre los dos carbonilos
REFERENCIAS
No hay comentarios:
Publicar un comentario