Las aminas son compuestos orgánicos derivados del amoniaco (NH3), y son producto de la sustitución de los hidrógenos que componen al amoniaco por grupos alquilo o arilo.
Las aminas se clasifican de acuerdo al número de sustituyentes unidos al nitrógeno en aminas primarias, aminas secundarias y terciarias.
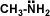
Amina primaria
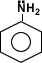
Amina primaria aromática
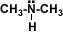
Amina secundaria
Solubilidad: Las aminas primarias y secundarias son compuestos polares, capaces de formar puentes de hidrógeno entre sí y con el agua, esto las hace solubles en ella. La solubilidad disminuye en las moléculas con más de 6 átomos de carbono y en las que poseen el anillo aromático
Las aminas presentan puntos de fusión y ebullición más bajos que los alcoholes. Así, la etilamina hierve a 17ºC, mientras que el punto de ebullición del etanol es de 78ºC.
CH3CH2OH P.eb. = 78ºC
CH3CH2NH2 P. eb. = 17ºC
La menor electronegatividad del nitrógeno, comparada con la del oxígeno, hace que los puentes de hidrógeno que forman las aminas sean más débiles que los formados por los alcoholes.
También se observa que las aminas primarias tienen mayores puntos de ebullición que las secundarias y estas a su vez mayores que las terciarias.
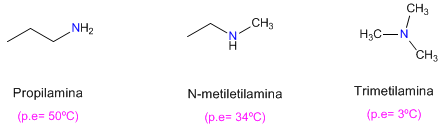
La amina terciaria no puede formar puentes de hidrógeno (carece de hidrógeno sobre el nitrógeno), lo que explica su bajo punto de ebullición.
En el caso de la amina secundaria, los impedimentos estéricos debidos a las cadenas que rodean el nitrógeno dificultan las interacciones entre moléculas.
Las aminas con menos de siete carbonos son solubles en agua.
ACIDO-BASE
Las aminas presentan hidrógenos ácidos en el grupo amino. Estos hidrógenos se pueden sustraer empleando bases fuertes (organometálicos, hidruros metálicos) formando los amiduros (bases de las aminas).
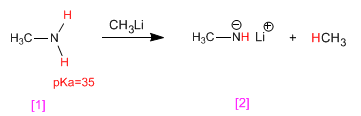
La metilamina [1] reacciona con metillitio, transformándose en su base conjugada, el metilamiduro de litio[2]. Por su parte, el metillitio se transforma en su ácido conjugado, el metano.
La desprotonación de la diisopropilamina produce una de las bases más utilizadas en química orgánica, el diisopropilamiduro de litio (LDA).
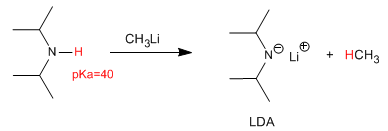
Sin embargo, el comportamiento más importante de las aminas es el básico. Las aminas son las sustancias orgánicas neutras de mayor basicidad.
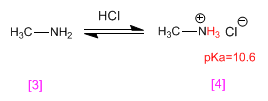
La metilamina [3] se protona transformándose en el cloruro de metilamonio (sal de amonio) [4]. Las sales de amonio son los ácidos conjugados de las aminas y tienen pKas que varían entre 9 y 11.
La basicidad de las aminas depende de los efectos inductivo y estérico. Así, el pKa sube con la longitud de la cadena carbonada (efecto inductivo)
CH3NH2 pKa=10.6
CH3CH2NH2 pKa=10.8
(CH3)3CNH2 pKa=10.4
La cadena carbonada cede carga al grupo amino, por efecto inductivo, aumentando su basicidad. La base fuerte tiene un ácido conjugado debil, por tanto el pKa sube. Pero si la cadena es muy voluminosa, comienzan a predominar efectos estéricos, que provocan una disminución del pKa.
Formación de sales
La propiedad más característica de las aminas es su capacidad para formar sales con los ácidos. Estas sales son semejantes a las sales de amonio. Se forman en solución acuosa o haciendo pasar HCl, HBr, HI, etc., a través de una solución eterea de la amina. La sal es un sólido blanco insoluble en éter. La reacción general es: Aminas
R - N H 2 + H X-----------> R - N H 3+ . X
Conversión en amidas
Las aminas primarias y secundarias reaccionan con los halogenuros de acilo para formar amidas.
La amina ataca al grupo carbonilo de un haluro de ácido de la misma forma que ataca al grupo carbonilo de una cetona o un aldehído. El cloruro de ácido es más reactivo que una cetona o un aldehído, porque el átomo electronegativo de cloro atrae a la densidad de electrones y la retira del carbono del carbonilo con lo que es más electrofílico. El átomo de cloro también es un buen grupo saliente.
Las bases nitrogenadas son compuestos orgánicos cíclicos, que incluyen dos o más átomos de nitrógeno. Son parte fundamental de los nucleósidos, nucleótidos, nucleótidos cíclicos (mensajeros intracelulares), dinucleótidos (poderes reductores) y ácidos nucleicos. Biológicamente existen seis bases nitrogenadas principales (en realidad hay muchas más), que se clasifican en tres grupos, bases isoaloxazínicas (derivadas de la estructura de la isoaloxazina), bases púricas o purínicas (derivadas de la estructura de la purina) y bases pirimidínicas (derivadas de la estructura de la pirimidina). La flavina (F) es isoaloxazínica, la adenina (A) y la guanina (G) son púricas, y la timina (T), la citosina (C) y el uracilo (U) son pirimidínicas. Por comodidad, cada una de las bases se representa por la letra indicada. Las bases ACTKK se encuentran en el ADN, mientras que en el ARN en lugar de timina existe el uracilo.
| Base nitrogenada | Nucleósido |
|---|---|
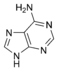 Adenina | 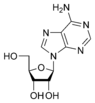 Adenosina A |
 Guanina |  Guanosina G |

No hay comentarios:
Publicar un comentario